Le groupe de coordination en matière de dispositifs médicaux publie une version préliminaire du formulaire de rapport de tendance des fabricants et des documents d'orientation

L’équipe de surveillance et vigilance après commercialisation du groupe de coordination en matière de dispositifs médicaux (GCDM) a publié le projet de formulaire de rapport de tendance et les documents d'orientation : Ils sont disponibles ici
Ces documents, ainsi que le compte rendu de la réunion, ont été téléchargés la semaine dernière.
REMARQUE : Tous les documents liés sont des versions préliminaires. Ils n'ont pas été officiellement publiés sur le site de la Commission. Les versions finales pourront différer, mais nous partageons dès à présent les projets afin d’offrir aux lecteurs un aperçu préliminaire du travail en cours.
Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
Formulaire de rapport de tendance des fabricants (MTR)
Le projet de formulaire MTR est disponible ici.
Ce formulaire préliminaire a été développé pour soutenir le futur rapport de tendance dans EUDAMED. Toutefois, il est partagé par anticipation afin d’aider les fabricants dans l’établissement de leur rapport de tendance, en attendant la pleine mise en service d’EUDAMED.
Jusqu'à ce qu'EUDAMED soit prêt, les fabricants doivent soumettre le formulaire à l'autorité compétente applicable conformément à MDCG 2021-1 (MDR) et MDCG 2022-12 (IVDR).
Une fois publié officiellement, le formulaire version MDR/IVDR remplacera la version MEDDEV.
Un document d'aide pour le MTR sera également mis à disposition, pour aider les fabricants à remplir le formulaire.

Image extraite de la présentation du groupe de travail GCDM intitulée « TF TREND REPORT PMSV February 2025 ».
Orientation du GCDM (Q&R) sur le rapport de tendance
La version préliminaire est disponible ici.
Veuillez noter qu'il n'a pas encore été publié officiellement ; d'où la désignation « MDCG 2025-X » dans le document. La version finale peut différer de celle-ci.

Image extraite de la présentation du groupe de travail GCDM intitulée « TF TREND REPORT PMSV February 2025 ».
Les sujets abordés incluent :
- Ce que signifie une « incidence significative sur l'analyse bénéfice/risque » et le contexte d'une « augmentation significative ».
- Comment gérer une tendance liée aux « effets secondaires indésirables attendus » ou aux « résultats erronés attendus ».
- Comment le rapport de tendance est lié au plan SAC et au SMQ.
- Quels documents doivent être soumis pour le rapport de tendance dans EUDAMED.
- Comment les fabricants doivent appliquer les exigences du rapport de tendance aux dispositifs sur mesure.
- Exemples de situations où un fabricant devrait envisager de soumettre un rapport de tendance (voir tableau ci-dessous).
| Règlement | Type | Raison de la tendance | Justification possible |
|---|---|---|---|
| MDR | Augmentation de la fréquence | Augmentation de la fréquence des éruptions cutanées causées par les patchs adhésifs. | Une augmentation statistiquement significative de la fréquence des incidents non graves, par rapport à la fréquence indiquée dans la documentation technique, peut indiquer des risques pour la sécurité des patients qui dépassent les bénéfices prévus. |
| Augmentation de la sévérité | Événements d'irritations oculaires non graves d'un dispositif ophtalmique s'aggravant en abrasions cornéennes. | Une augmentation significative de la sévérité des incidents non graves suggère une déviation de l'analyse bénéfice/risque du dispositif documentée dans la documentation technique et pourrait entraîner des risques inacceptables pour la population de patients. | |
| Augmentation de la fréquence ou de la sévérité des effets secondaires indésirables attendus | Événements de douleurs abdominales et de nausées après l'implantation d'un stérilet contraceptif. | Une augmentation statistiquement significative de la fréquence ou de la sévérité des effets secondaires indésirables attendus, par rapport aux niveaux anticipés dans la documentation technique, entraîne un risque inacceptable pour la population de patients visée. | |
| IVDR | Augmentation de la fréquence | Augmentation des résultats invalides d'un test de cholestérol, où les exécutions invalides dépassent 5 % du total des exécutions. | Une augmentation statistiquement significative des résultats invalides impacte la performance du dispositif par rapport aux spécifications de performance documentées. |
| Augmentation de la sévérité | Résultats faussement positifs d'un test de carence en vitamine B12 entraînant des injections inutiles. | Une augmentation de la sévérité des résultats erronés affecte l'analyse bénéfice/risque, en exposant les patients à des interventions inutiles. | |
| Augmentation de la fréquence ou de la sévérité des effets secondaires indésirables attendus | Augmentation des résultats faussement négatifs d'un test de protéine urinaire, causant des retards dans l'identification d'une dysfonction rénale à un stade précoce. | Une augmentation statistiquement significative de la fréquence des résultats erronés attendus par rapport à sa performance déclarée entraîne des risques inacceptables pour la population de patients plus large. |
Tableau reproduit à partir du document d'orientation préliminaire (p. 19-20).
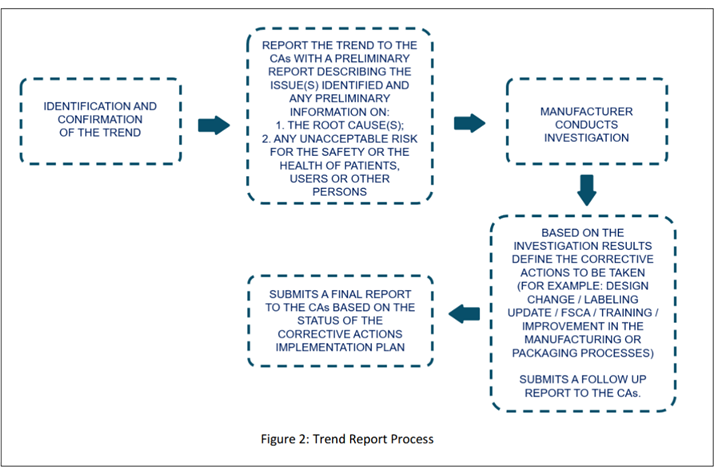
Image extraite du document d'orientation préliminaire (p. 15).
Document de rapport de tendance des fabricants
La version préliminaire est disponible ici.
Les fabricants doivent utiliser ce document pour fournir des détails supplémentaires qui ne peuvent pas être saisis dans le formulaire MTR.
Il comprend quatre sections :
- Description des dispositifs concernés par la tendance
- Description de la tendance
- Analyse du fabricant sur la tendance à déclarer
- Actions correctives
Le modèle fournit des conseils à la fois pratiques (par exemple, comment soumettre avant qu'EUDAMED ne soit fonctionnel) et techniques (par exemple, type et niveau d'information attendu).
Rapport d'incident grave et FSCA
Le compte rendu de la réunion note que :
- L'orientation sur les incidents graves est en cours de développement. Il s'agit d'un nouveau document sur les attentes de l'autorité compétente et les meilleures pratiques. Au moment de la réunion, les commentaires de l'autorité compétente avaient été consolidés.
- Le rapport FSCA mis à jour est en cours de développement et devrait être finalisé au troisième trimestre 2025.

Cet article a été à l’origine écrit en anglais par Casus Consulting. Cette version est traduite de l’anglais original par AbroadLink : Le groupe de coordination en matière de dispositifs médicaux publie une version préliminaire du formulaire de rapport de tendance des fabricants et des documents d'orientation. Vous pouvez accéder à l’original publié sur le site web de Casus Consulting en cliquant sur le titre de l’article.



Ajouter un commentaire